한국화이자제약(주)의 보술리프정 100, 400, 500밀리그램 (보수티닙일수화물) 정제가 2023년 01월 12일 국내 허가된 후 허가 정보가 공개되었다. 품목허가 심사 시 어떠한 자료가 제출되었는지 같이 살펴보도록 하자.
의약품 기본 정보
- 제품명 : 보술리프정100밀리그램(보수티닙일수화물), 보술리프정400밀리그램(보수티닙일수화물), 보술리프정500밀리그램(보수티닙일수화물)
- 성상 : 노란색의 양면이 볼록한 필름코팅정(100mg), 주황색의 양면이 볼록한 타원형 필름코팅정(400mg), 빨간색의 양면이 볼록한 타원형 필름코팅정(500mg)
- 업체명 : 한국화이자제약(주)
- 의약품 분류 : 전문의약품
- 허가일 : 2023-01-12
- 허가심사유형 : 신약
- 원료약품 및 분량 : 보수티닙일수화물, 미결정셀룰로오스, 오파드라이II노란색 또는 빨간색, 포비돈, 스테아르산마그네슘, 폴록사머, 크로스카멜로오스나트륨 (용량별 상이)
- 효능효과 : 다음과 같은 성인환자의 치료
1. 새로 진단된 만성기(CP)의 필라델피아염색체 양성 만성골수성백혈병 (Ph+ CML)
2. 이전요법에 내성 또는 불내약성을 보이는 만성기, 가속기(AP), 또는 급성기(BP)의 필라델피아염색체 양성 만성골수성백혈병(Ph+ CML) - 용법용량 요약 : 1일 1회 음식물과 함께 경구투여. 질병의 진행이나 이전 요법에 내성 또는 불내약성을 보이는 경우, 이상반응이 발생한 경우 등에는 명시된 용법용량에 따라 적절히 용량을 조절한다.
- 저장방법 : 기밀용기, 실온보관(1~30℃)
- 사용기간 : 제조일로부터 48개월
- 재심사 대상 : 6년
- RMP 대상 : O
- 포장정보 : 28정/상자(14정/블리스터x2), 112정/상자(14정/블리스터x8)
허가 심사 정보
- 국외 허가현황 : 미국허가 (2012.9.4), 유럽허가 (2013.3.27)
- 허가부서 : 허가총괄담당관
- 심사부서 : 종양항생약품과(안유), 첨단의약품품질심사과(기시), 의약품안전평가과(위해성)
- GMP 평가부서 : 의약품품질과
- 검토일정
2021.11.30 : 품목허가 민원신청
2022.03.04 : 1차 보완요청
2022.11.04 : 1차 보완접수
2022.12.06 : 2차 보완요청
2022.12.16 : 2차 보완접수
2023.01.12 : 최종처리
제출자료 심사
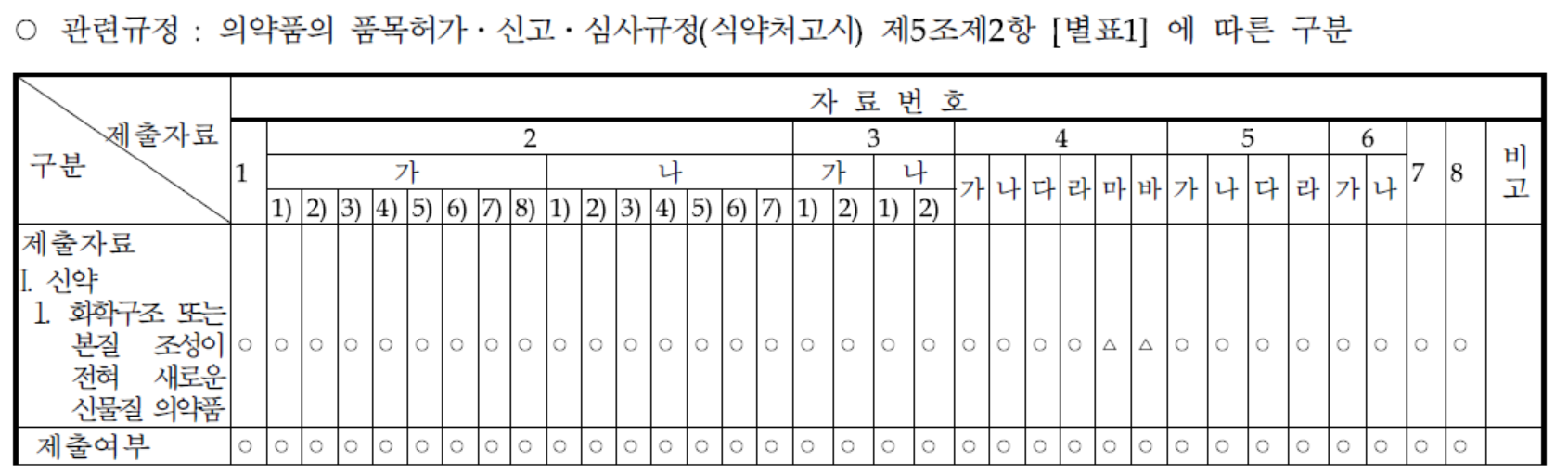
화학구조 또는 본질조성이 전혀 새로운 신물질 의약품으로서 신약 제출범위의 모든 자료가 제출되었음을 알 수 있다. 각 제출자료 별 자료는 아래에 요약하였다.
1. 기원 또는 발견 및 개발경위에 관한 자료
강력한 선택적 이중 Src/Abl 키나제 억제제로서 이전 TKI 치료이력이 있거나 새로 진단된 필라델피아염색체 양성(Ph+) 만성골수성백혈병 치료제로 제안되었다.
2. 구조결정, 물리화학적 성질에 관한 자료 (품질에 관한 자료)
원료의약품
- 명칭 : 보수티닙일수화물 (Bosutinib Monohydrate)
- 구조식 :

- 품질 시험항목 : 성상, 확인시험, 순도시험(유연물질, 잔류용매시험, 중금속), 건조감량/강열감량/수분, 강열잔분/회분/산불용성회분, 기타시험, 정량법
완제의약품
- 첨가제의 종류 : 미결정셀룰로오스, 오파드라이II노란색 또는 빨간색, 포비돈, 스테아르산마그네슘, 폴록사머, 크로스카멜로오스나트륨 (용량별 상이)
- 품질 시험항목 : 성상, 확인시험, 순도시험(유연물질), 함량시험, 붕해/용출시험, 질량(용량)편차/제제균일성시험
3. 안정성에 관한 자료
완제의약품을 PVC/PCTFE/PVC Blister Film, Al foil에 넣어 25±2℃/60±5% RH에서 장기보존시험, 40±2℃/75±5% RH에서 가속시험을 수행하였고 기준에 적합하였다. 또, 온도, 습도, pH, 광 조건의 가혹시험자료도 제출되었다. 해당 자료로 기밀용기, 실온보관(1~30℃), 제조일로부터 48개월이 인정되었다.
4. 독성에 관한 자료


신약으로서 모든 독성시험 자료가 제출되었다.
- 표적 장기로서 용량-반응 관계를 나타내는 위장관계 독성이 주요 소견이었으며 이로 인해 체중 및 식이 감소, 분변의 변화가 유발되었다.
- 생식발달 관련, 독성이 관찰되지 않은 노출량은 400mg, 인체 노출 대비 수태능의 경우 0.3~0.6배, 배태자 발달의 경우 1.6배(랫드), 0.9배(토끼)였고 출생전후 발달의 경우 1.3배 였다.
- 표준조합 1에 따른 유전독성시험 결과 음성이며 발암성, 광독성의 증거는 관찰되지 않았다.
5. 약리작용에 관한 자료
- 효력시험자료 : 필라델피아 염색체에 존재하는 BCR-ABL 융합 유전자는 CML의 뚜렷한 표지자로서 티로신 키나제의 일종인 Bcr-Abl 단백질을 생성하며, 보수티닙은 Abl 키나제 억제제로서 Sr군 키나제 Lyn, CrkL 및 Stat5 등 하위 표적 단백질의 인산화를 억제하여 CML 치료 효과를 나타내었다. K562 만성 골수성 백혈병 모델에 5일 투여 시 최소 15mg/kg 용량에서 유효성이 관찰되었다.
- 약동학시험자료 : PK(TK), ADME에 대한 랫드, 비글견 등 동물시험 및 시험관내 평가를 실시하였다.
- 안전성 약리시험 : CNS, 호흡기계, 심혈관계 영향 평가를 실시하였다.
6. 임상시험성적에 관한 자료


임상시험성적에 관한 자료는 GCP를 준수하여 수행되었으며, 제출자료 공증본을 제출하여 임상시험 자료의 신뢰성을 확보하였다. 위의 표에서 민트색 표시된 임상시험은 핵심 임상시험(Pivotal studies)으로, 3상(B1871053, AV001) 및 1/2상(B1871006, 200-WW)에서 다국가 임상시험으로 진행되었기에 그 중의 한국인과 비교 분석한 자료를 제출하여 가교자료로도 인정되었다.
7. 외국의 사용현황에 관한 자료
미국, 유럽, 일본 등의 외국 사용 현황에 대해 제출하였다.
8. 국내 유사제품과의 비교검토 및 당해 의약품등의 특성에 관한 자료
국내 CML 치료제와 비교한 자료를 제출하였다.
9. 위해성 관리 계획
- 중요한 규명된 위해성 : 간독성, 위장관 독성(설사, 오심, 구토), QT 연장, 신기능 장애에 대한 항목과 SJS/TEN, CYP3A4 억제제와의 상호작용으로 인한 독성 증가, CYP3A4 유도제와의 상호작용으로 인한 유효성 결여, PPI 와의 상호작용으로 인한 유효성 결여 항목을 감시하고 시판 후 조사
- 중요한 잠재적 위해성 : 심독성(QT 연장 제외) 항목을 감시하고 시판 후 조사
- 중요한 부족정보 : 소아 환자에서의 사용과 심장애 환자에서의 안전성, 임상적으로 유의한 위장관 장애가 최근에 있었거나 진행 중인 환자에서의 안전성, 장기 안전성(>365일) 항목을 감시하고 시판 후 조사
위의 의약품 허가 정보는 의약품안전나라(NEDRUG)의 의약품등 정보 > 의약품등 정보검색 탭에서 확인할 수 있다.
'의약품 인허가' 카테고리의 다른 글
| 2024년도 새해 맞이 임상시험 실시상황 보고는 필수인거 알죠? (4) | 2024.01.04 |
|---|---|
| 반추동물 유래성분의 TSE 미감염 관련 제출자료 (0) | 2023.04.10 |
| 의약품 임상시험계획승인(IND) 절차 (0) | 2023.03.31 |
| 의약품 품목허가 제출서류 국문(영문) 정리 (0) | 2023.03.30 |
| 의약품 RA가 하는 일 (feat. 제약회사 RA와 CRO RA 비교) (4) | 2023.03.29 |




댓글